- 부정맥부정맥 유발성 심근병증에 대한 새로운 미국 부정맥 학회의 권고문
- 부정맥심실빈맥의 전극도자 절제술에 대한 미국/유럽/아시아/라틴 아메리카 부정맥 학회의 권고문
- 중재술심혈관 중재술을 받은 환자, 과연 출혈로부터 안전한 것인가?
- 중재술급성심근경색증 환자에서 약물용출성 풍선이 약물용출성 스텐트와 유사한 성적을 보였다.
- 중재술Small Coronary Artery Disease 환자에서 Ultrathin Strut Coronary Stent의 유용성
- 심부전관상동맥 질환이 있는 심부전 환자는 정상 심박동이라 하더라도혈전색전증의 위험이 높으면, Rivaroxaban 의 사용이 도움이 될 수 있다.
- 고혈압2019 유럽고혈압학회 주요 이슈 정리
- 기초미리 가보는 ISSCR 2019 Annual Meeting (6월 26일~29일)
- 동맥경화심혈관 건강을 위해 아침식사 꼭 합시다.
미리 가보는 ISSCR 2019 Annual Meeting (6월 26일~29일)
올해 ISSCR은 미국 줄기세포 연구의 메카인 Los Angeles에서 열린다. 이미 4000명 이상이 등록하였으며 200명이 넘는 연자들이 강연을 준비하고 있다. 7개의 Plenary Session을 통해 줄기세포 연구 및 재생의학 분야에서 가장 뛰어난 연구자들이 최첨단 기술과 연구결과를 발표할 예정이다. 특히, 2012년 노벨 생리의학상을 수상한 Shinya Yamanaka 교수가 ‘Recent progress in iPS cell research and application’이라는 제목으로 발표할 예정이다. 이번 ISSCR에서는 iPS cell을 활용한 다양한 연구들이 많이 발표될 예정이므로, 여기에서는 iPSC로부터 분화된 심근세포를 심장재생, 심장 질환 모델 확립, 환자 맞춤형 신약 개발에 적용하는 방법에 대하여 기술한다.
iPS cell의 개발 역사
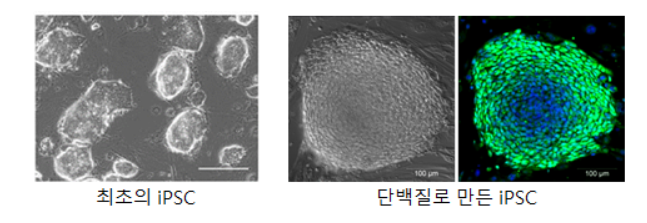
1958년 Gurdon 박사 (2012년 노벨 생리의학상 공동 수상자)가 개구리의 장에서 분리한 세포의 핵을 난자의 핵과 치환하여 개체를 만들어내는 데 성공하였다1. 이 결과는 체세포의 핵이 리프로그램되어 줄기세포로 전환될 수 있음을 규명한 최초의 사례였다. 여기에 영감을 받은 Yamanaka 박사가 2006년에 4 가지 유전자 (Oct4, Sox2, Klf4, c-Myc)를 체세포에 주입한 후 발현을 유도하여 배아줄기세포와 유사한 세포를 만들어 냈다. 이것이 최초의 induced pluripotent stem (iPS) cell이다2. 그 이후에도 iPS cell을 확립하는 다양한 방법이 개발 되었고, 서울대병원에서는 유전자 조작 없이 단백질만을 이용하여 iPS cell을 만들어 임상적용에 한 발 더 다가갈 수 있게 되었다3.
iPS cell의 분화유도를 통한 심근세포의 확립
iPS cell을 심장 질환을 치료하는데 활용하기 위한 첫 걸음은 cardiac myocyte (심근세포)로 분화를 유도하는 것이다. Activin A, BMP4와 같은 cytokine들을 최적화된 농도로 iPS cell에 처리하면 심근세포로 분화 시킬 수 있다. 그러나 이러한 방법으로는 분화 효율이 매우 낮고, 미성숙한 심근세포를 얻게 된다. 이를 극복하기 위하여 microRNA인 let-7을 분화 중에 첨가하면 phosphoinositide 3 kinase/AKT pathway를 억제하고, fatty acid metabolism을 활성화하여 성숙된 심근세포를 얻을 수 있다4. 그러나 심근세포를 세포치료제로 활용하거나 약물 검사를 위한 시스템으로 활용하기 위해서는 넘어야 할 산이 아직 많이 남아있다. 특히 electrophysiological 특성을 정상적인 심근세포와 같이 맞추어야 하고, 분화가 유도된 모든 심근 세포들이 동일한 성상을 가져야 한다. 이를 위해서는 앞으로 많은 연구가 필요하다.
iPS cell을 이용한 Drug screening
왜 iPS cell로 만든 심근세포로 신약 활성 및 독성 검사를 해야 할까?
첫째, 대부분의 비임상 실험에 사용되는 동물은 마우스이다. 그러나 마우스와 사람은 electrophysiological 특성이 상당히 다르다. 또한 마우스의 심장박동은 사람보다 훨씬 빠르다. 그러므로 사람에 적용될 약을 개발하기 위해서는 사람의 심근세포를 사용하여 테스트해야 한다. 둘째, iPS cell은 환자로부터 직접 만들 수 있기 때문에 질환 모델을 만드는데 매우 적합하다. 셋째, in vivo에서는 복잡한 주위환경에 의해 결과가 다르게 나올 수 있으나, iPS cell로부터 분화된 심근세포는 약물의 단독 효과를 검사 할 수 있다. 넷째, 다양하고 복잡한 유전적 결함도 반영할 수 있을 뿐 아니라, CRISPR/Cas9을 이용하여 다양한 SNP를 가진 심근세포도 제작할 수 있다. 이러한 장점을 가진 iPS cell 유래 심근세포는 신약 개발과 독성 검사에 이미 활용되고 있다.
환자로부터 iPS cell을 만들어 병의 원인을 규명하는 Disease modeling
다양한 심장 질환 환자로부터 만든 iPS cell을 심근세포로 분화시켜서 병의 원인을 규명하는 노력이 시도되고 있다. 여기서 최근 보고된 논문을 기반으로 몇 가지 예를 들어본다.
- Cardiac Arrhythmias model : iPS cell을 이용하여 가장 처음 만들어진 질병모델은 long QT syndrome (LQTS)이다. LTQS1, LTQS2, LTQS3에 대한 모델이 보고 되었는데, 그 중 2011년 Nature에 보고된 LTQS2에 대해 간략히 소개한다. LTQS2 환자로부터 iPS cell을 만들고 심근세포로 분화시켜서 KCNH2 mutation (KCNH2-A614V)에 의해 장기 작용전위가 지속되고, Ikr current가 감소되어 질병이 유발되었음을 규명하였다5.
- Cardiomyopathy model : LEOPARD syndrome 환자로부터 만든 iPS cell을 심근세포로 분화시켜 유전체를 분석하였더니, 이 환자의 심근세포에서 PTPN11 유전자의 돌연변이가 검출되었다. PTPN11은 protein tyrosine phosphatase SHP2이고, RAS/MAPK 신호전달 경로에서 중요한 역할을 한다. 이 환자의 경우 PTPN11 돌연변이에 의해 세포의 크기가 커졌고, NFATC4의 nuclear translocation이 확인되었다6. 이는 hypertrophic cardiac myocytes에서 발견되는 공통되는 특징이다.
- Mitochondrial disease model : Barth syndrome은 TAZ 유전자의 돌연변이에 의해 발생하는 심장 질환이다. TAZ의 돌연변이는 마이토콘드리아의 구조와 기능에 이상을 일으킨다. 이 환자의 iPS cell을 만들어 심근 세포로 분화시킨 다음, 마이토콘드리아를 관찰해 보면 그 기능이 현저히 떨어져 있었다. 즉, 비정상적인 수축성을 나타냈으며 ROS가 증가되어 있었다. Barth syndrome의 심근세포에 마이토콘드리아에 대한 항산화제를 처리하면 비정상적인 마이토콘드리아의 기능이 정상으로 회복되는 것을 보여줬다7. 새로운 치료제 개발 가능성을 보여준 사례라고 할 수 있다.
iPS cell을 활용한 심근 재생
심근재생을 위해 iPS cell로부터 심근세포로 분화 유도하여 환자의 심장에 이식하면 host 심근세포와 gap junction을 형성하며 1:1로 착상된다8. 또한 생장인자를 분비하여 host 심근세포의 생장에 도움을 준다. 그러나 아직 이식에 사용된 세포들의 생착 효율이 낮은 것이 임상적용의 걸림돌이다. 이를 극복하기 위하여 Hydrogel에 세포를 넣어서 착상 효율을 높이는 방법, 다양한 cytokine (IGF-I, cyclosporine A)을 함께 넣어주는 방법 등이 연구되고 있다.
결론
iPS cell은 다양한 질환의 환자로부터 만들 수 있고, 생체검사가 어려운 심장, 뇌와 같은 조직을 실험실에서 구현할 수 있기 때문에 병의 기전을 연구하는데 매우 유익한 시스템이라고 할 수 있다. 심장질환 환자들로부터 확립된 iPS cell을 이용한 다양한 질병 모델도 소개한 바 있다. 세계적인 규모의 제약회사들은 신약을 개발할 때, screening system으로 iPS cell을 이용한 심근세포 platform을 활용하여 상당한 비용절감을 통해 경쟁력을 확보하고 있다.
또한 다양한 genetic background와 돌연변이를 가지고 있는 환자의 경우, 최근에 개발된 Genome editing 기술로 교정하여 본인에게 다시 이식하는 방법도 개발되고 있다. 이렇듯이 iPS cell은 최근 발전하고 있는 정밀의료 기술을 접목하여 상당히 파워풀한 도구로 각광받고 있다.
이미 일본에서는 노인성 황반변성 환자들을 대상으로 수년전부터 임상시험에 돌입하여 안전하고 효율적인 치료제 개발에 박차를 가하고 있다. 우리나라도 과감한 규제개혁과 투자를 통해 이 분야의 발전을 도모해야 할 것이다.
Reference
1) Sexually mature individuals of Xenopus laevis from the transplantation of single somatic nuclei. GURDON JB, ELSDALE TR, FISCHBERG M. Nature. 1958 Jul 5;182(4627):64-5.
2) Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Takahashi K, Yamanaka S. Cell. 2006 Aug 25;126(4):663-76.
3) Induction of pluripotent stem cells from adult somatic cells by protein-based reprogramming without genetic manipulation. Cho HJ, Lee CS, Kwon YW, Paek JS, Lee SH, Hur J, Lee EJ, Roh TY, Chu IS, Leem SH, Kim Y, Kang HJ, Park YB, Kim HS. Blood. 2010 Jul 22;116(3):386-95.
4) Let-7 family of microRNA is required for maturation and adult-like metabolism in stem cell-derived cardiomyocytes. Kuppusamy KT, Jones DC, Sperber H, Madan A, Fischer KA, Rodriguez ML, Pabon L, Zhu WZ, Tulloch NL, Yang X, Sniadecki NJ, Laflamme MA, Ruzzo WL, Murry CE, Ruohola-Baker H. Proc Natl Acad Sci USA. 2015; 112:E2785–E2794.
5) Modelling the long QT syndrome with induced pluripotent stem cells. Itzhaki I, Maizels L, Huber I, Zwi-Dantsis L, Caspi O, Winterstern A, Feldman O, Gepstein A, Arbel G, Hammerman H, Boulos M, Gepstein L. Nature. 2011; 471:225–229
6) Patient-specific induced pluripotent stem-cell-derived models of LEOPARD syndrome. Carvajal-Vergara X, Sevilla A, D’Souza SL, Ang YS, Schaniel C, Lee DF, Yang L, Kaplan AD, Adler ED, Rozov R, Ge Y, Cohen N, Edelmann LJ, Chang B, Waghray A, Su J, Pardo S, Lichtenbelt KD, Tartaglia M, Gelb BD, Lemischka IR. Nature. 2010; 465:808–812.
7) Modeling the mitochondrial cardiomyopathy of Barth syndrome with induced pluripotent stem cell and heart-on-chip technologies. Wang G, McCain ML, Yang L, He A, Pasqualini FS, Agarwal A, Yuan H, Jiang D, Zhang D, Zangi L, Geva J, Roberts AE, Ma Q, Ding J, Chen J, Wang DZ, Li K, Wang J, Wanders RJ, Kulik W, Vaz FM, Laflamme MA, Murry CE, Chien KR, Kelley RI, Church GM, Parker KK, Pu WT. Nat Med. 2014 Jun;20(6):616-23.
8) Human ES-cell-derived cardiomyocytes electrically couple and suppress arrhythmias in injured hearts. Shiba Y, Fernandes S, Zhu WZ, Filice D, Muskheli V, Kim J, Palpant NJ, Gantz J, Moyes KW, Reinecke H, Van Biber B, Dardas T, Mignone JL, Izawa A, Hanna R, Viswanathan M, Gold JD, Kotlikoff MI, Sarvazyan N, Kay MW, Murry CE, Laflamme MA. Nature. 2012 Sep 13;489(7415):322-5.