- 고혈압의 병태생리면역, 염증 반응은 고혈압을 유발하는 주요한 병인 기전이다
- 고혈압의 병태생리노인성 심혈관 질환의 주범 중 하나인 혈관 노화는 DNA 손상에 의해 유발될 수 있다.
- 고혈압의 병태생리고혈압은 좌심실 수축기능이 보전된 심부전 발생의 가장 큰 기여인자다
- 고혈압의 병태생리 이차성 고혈압의 원인인 섬유근육형성이상의 유병률은 증가하고 있다
- 고혈압의 진단자가 혈압모니터 어디까지 왔고 어디로 가나
- 고혈압의 진단야간고혈압, 손목혈압계 다시 주목받나
- 고혈압의 진단효과적인 고혈압 진단 및 치료를 위한 새로운 전략
- 고혈압의 치료3제 고정용량복합제는 고혈압 치료의 새로운 장을 열 것이다
- 고혈압의 치료코로나 19시기 혈압 조절의 정도는 심혈관질환의 발생에 어떤 영향을 미칠까
- 고혈압의 치료임신성 고혈압의 응급 상황에서는 라베탈롤, 하이드랄라진, 속효성 경구 니페디핀을 사용한다
- 고혈압의 치료고위험 고혈압 환자에서 신장신경차단술은 효과적이다
노인성 심혈관 질환의 주범 중 하나인 혈관 노화는 DNA 손상에 의해 유발될 수 있다.
DNA Damage: A Main Determinant of Vascular Aging
혈관은 심혈관 질환과 밀접한 관련이 있는 것이 잘 알려져 있어서 많은 연구가 되고 있는 분야이다. 최근에는 혈관 노화가 노인들의 건강한 삶을 유지하고, 생명을 연장하는데 매우 중요한 요소로 주목받기 시작했다. 혈관 내피의 변형은 혈관확장 장애, 염증 유발, 혈전 분자의 과잉생산, 산화 스트레스를 일으키며 이로 인해 심혈관질환이 촉발되어 우리의 건강을 위협하고 있다. 이러한 혈관 내피의 변형을 유발하는 많은 요인이 알려져 있지만, 우리가 거스를 수 없는 노화 또한 혈관의 건강을 해치는 주요 인자라 할 수 있다. Clonal hematopoiesis를 포함하는 다양한 주제들이 노화로 인한 심혈관 질환 발생을 억제하는 방법을 찾기 위해 연구되고 있다. 노화와 관련된 다양한 위험 요인들에 대한 최신 지견을 모아 ESH-ISH 2021에서는 ‘Ageing’ 세션을 특별히 마련하였다.
전통적으로 혈관의 손상을 유발하는 분자생물학적 기전으로는 ROS (Reactive oxygen species)와 ROS의 증가로 인한 NO (nitric oxide)의 생물학적 활성이 감소하는 것이 잘 알려져 있다. NO는 혈관 확장, 혈관 세포 성장 및 혈전증을 예방하는 기능이 있어 NO의 생체 내 밸런스가 깨어지게 되면 심혈관 질환 발병 확률이 매우 높게 된다. ROS는 노화로 인해 발생하는 산물로도 알려져 있으므로 ROS와 NO를 주제로 한 노화 연구는 많은 과학자들의 결과들이 집대성되어 있다. 그러나, 아직 노화에 의해 발생되는 질병 문제는 해결되지 않았기 때문에 우리는 다른 기전에 대해서도 관심을 가질 필요가 있다.
여기에서는 DNA damage가 발생되는 원인, DNA 손상을 복구하는 세포 내 기전을 설명하고, DNA 손상이 제대로 복구되지 않을 경우 세포 내에서 초래되는 혈관 노화 (vascular ageing) 현상들에 대해 이번 학회에서 발표된 내용과 관련 논문을 정리하였다.
노화가 진행되면 유전체의 일부에서 돌연변이가 발생하게 되는데, 이를 예방하고 유전체를 잘 보존하는 것이 매우 중요하다. 특히 DNA가 손상된 것을 잘 인지하고 수리하는 시스템이 잘 발달되어야 유전체를 잘 보존할 수 있다.
DNA를 손상시키는 원인은 매우 다양하지만, DNA를 구성하는 분자의 hydrolysis, 생체내에서 발생하는 대사 산물, UV light, 여러가지 화학물질과 앞서 언급한 ROS도 DNA 손상을 유발하는 것이 알려져 있다. 이러한 위협으로부터 DNA의 손상을 수리하기 위한 세포내 기전으로는 mismatch된 DNA 염기를 교체 (Base excision repair; BER) 해 주거나 single strand break를 일으키고, nucleotide를 잘라내고 수리하거나 (Nucleotide excision repair; NER), homologous recombination (HR) 또는 non-homologous end joining (NHEJ)이 알려져 있다. 이렇게 DNA 손상을 복구하려는 많은 노력에도 불구하고 손상된 DNA가 그대로 남아 있을 경우 우리 세포는 그 다음 보호 기전으로 ‘자살’ 작전을 펼치게 된다. 즉, 세포의 자발적 사멸이 발생하여 불완전하고 손상된 유전체를 생체 내에서 제거하게 된다.
조로증후군 (Progeria syndrome) 환자들에 대한 심혈관 질환의 유병율이 높은 것이 보고되어 있지만, 그 정확한 기전은 알려져 있지 않았다. 조로증후군의 하나인 베르너 증후군 (Werner syndrome)의 경우, DNA 복제, 복구에 중요한 역할을 하는 helicase를 코딩하는 WRN (Werner) gene의 돌연변이가 주된 원인이라는 것은 오래전에 알려졌지만 (1), 그 외에 다른 조로증후군 유전자들에 대한 보고는 많지 않다.
본 학회의 발표자는 DNA 복구에 주요하다고 알려진 Excision repair cross-complementation group 1 (ERCC1)의 결손이 노화 작용을 유발하는 것을 발견하였고, 그 유전자가 제거된 Knockout 마우스를 이용한 결과를 통해 기전을 규명하였다.
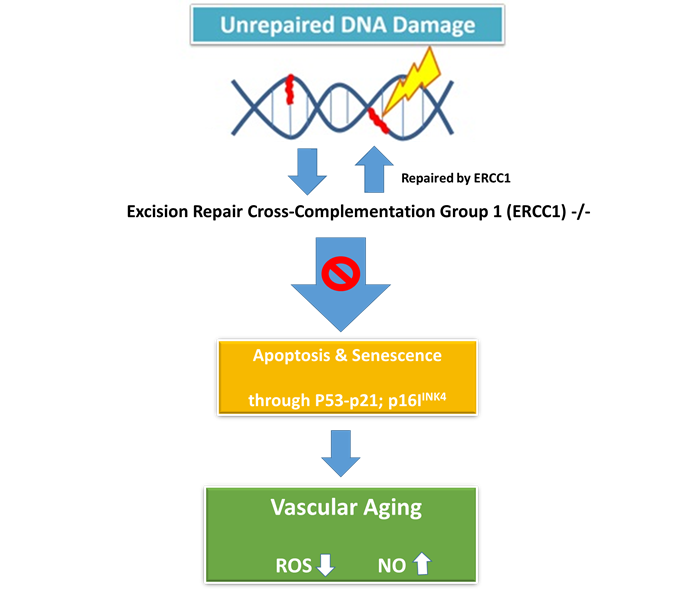
Ercc1−/− mice는 다양한 노화 표현형을 가지고 있는데, 예를 들면, 골다공증, 신경 퇴행, 근육 감소증, 간 및 신장 기능 장애 등이 있다 (2). 또한 이 마우스는 미세혈관의 혈관확장 능력이 현저히 떨어지는 것도 관찰되었다. 이 마우스를 이용한 다양한 실험을 통해 결국 p53과 p21이 관련된 노화 기전이 규명되었는데, 이들의 하위에 있는 p16INK4가 높게 발현되는 노화 세포가 적절히 제거되지 못하는 것이 혈관 노화의 주된 이유임을 밝혔다. 최근 연구결과에 따르면 p16INK4가 양성인 노화세포를 잘 제거하게 되면 심장에 미치는 스트레스 민감성을 감소시키고 생명 연장이 가능하다고 한다 (3, 4).
이 강의의 결론은 Ercc1이 p53-p21-p16의 작동을 정상적으로 유지하게 하는 기능이 있어서 유전체가 비정상적인(Genomic instability) 세포를 제거하게 되는데, 이 유전자가 제대로 작동하지 못하게 되면 혈관 노화에 따른 심혈관 질환의 유발 가능성을 높이게 된다는 것이다 (5).
그러므로 혈관 노화를 유발하는 비정상적인 유전체 발생을 예방하고 복구하는 것과 관련된 다양한 연구가 앞으로 많이 필요할 것으로 사료된다.
참고문헌
1) Werner’s syndrome a review of its symptomatology, natural history, pathologic features, genetics and relationship to the natural aging process. Epstein C.J., Martin G.M., Schultz A.L., Motulsky A.G. Medicine (Baltimore) 1966; 45:177–221.
2) Disruption of mouse ERCC1 results in a novel repair syndrome with growth failure, nuclear abnormalities and senescence. Weeda G, Donker I, de Wit J, Morreau H, Janssens R, Vissers CJ, Nigg A, van Steeg H, Bootsma D, Hoeijmakers JH. Curr Biol. 1997; 7(6):427-39.
3) Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Baker DJ, Childs BG, Durik M, Wijers ME, Sieben CJ, Zhong J, Saltness RA, Jeganathan KB, Verzosa GC, Pezeshki A, Khazaie K, Miller JD, van Deursen JM. Nature. 2016; 530(7589):184-9.
4) Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, Kirkland JL, van Deursen JM. Nature. 2011; 479(7372):232-6.
5) DNA Damage: A Main Determinant of Vascular Aging. Bautista-Niño PK, Portilla-Fernandez E, Vaughan DE, Jan Danser AH, Roks JM. Int J Mol Sci. 2016;17(5):748.



